Technology 技術紹介
解決すべき課題
01細胞治療における課題
近年、細胞治療の実用化、臨床応用が進んでいます。しかし、体性細胞や体性幹細胞を活用した製品が中心であり、細胞の不均一性や使用可能な細胞数の制限などが、より幅広い患者さまに向けた臨床応用への大きな制約となっています。それに対し、iPS細胞をはじめとする多能性幹細胞は様々な細胞への分化が可能で、無限に近い形で増殖させることができるため、細胞治療の普及に向けた大きな可能性を有しています。
一方で、多能性幹細胞においては安全性の確保が重要です。多能性幹細胞の無限増殖能には、移植された生体内で腫瘍のように増殖してしまうリスク(造腫瘍性リスク)があり、増殖しない場合でも、移植した細胞が期待した働きを示さない場合に投与した細胞が排除できません。この点が細胞治療における大きな課題となっています。

02遺伝子治療における課題
細胞治療だけでなく、遺伝子治療も近年目覚ましい発展を示しています。生体外で細胞に遺伝子を導入するex vivo遺伝子治療は、血液がん治療を中心に大きな成功を収めています。さらに、2012年のCRISPR/Cas9を用いたゲノム編集技術の登場以降、体内の遺伝子を直接書き換えるin vivo遺伝子治療の実用化が進んでいます。この遺伝子治療は、主にウイルスを遺伝子の運び屋として使用するもので、疾患の根本的治療法として大きな期待がかけられています。
ただしin vivo遺伝子治療において重要なのが、遺伝子の必要な部位への送達です。ウイルス自身は遊走性をもたないため、そのままでは浸潤腫瘍等の疾患患部への集積が不十分なことが課題として挙げられます。

ソリューション
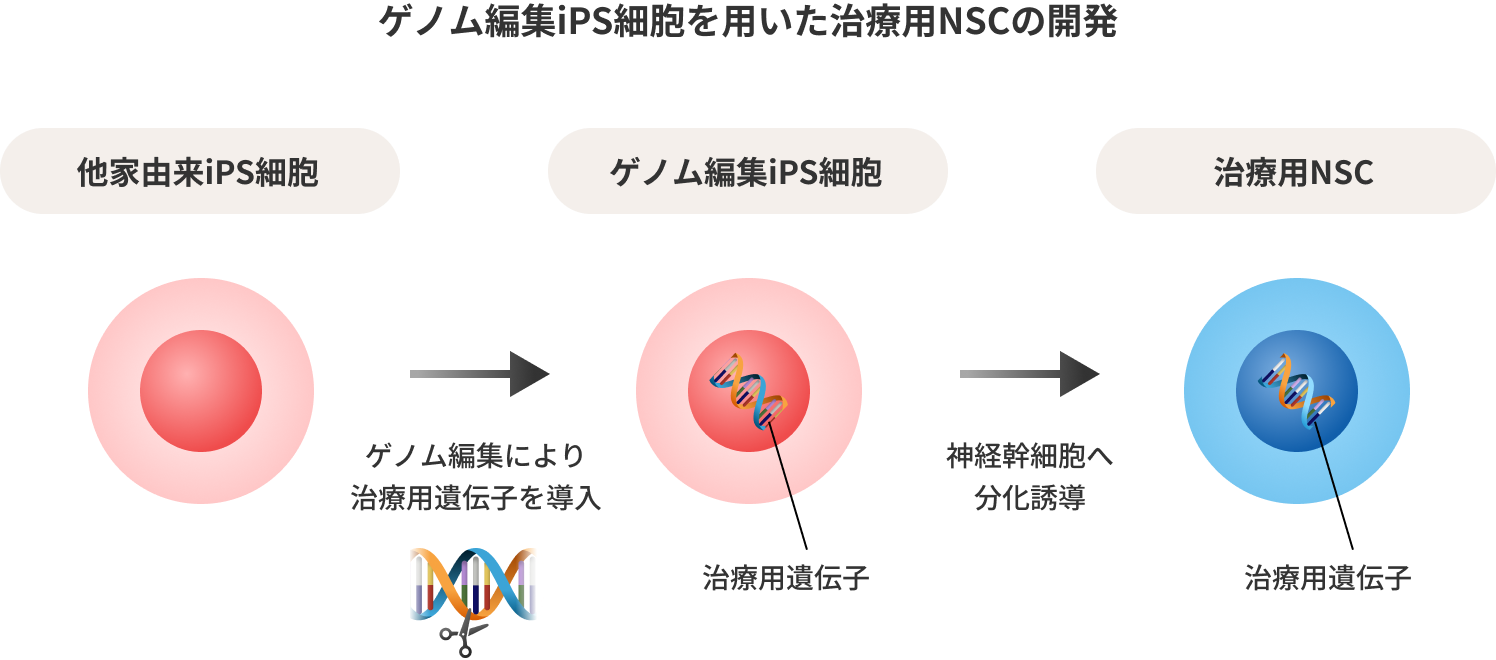
私たちは、細胞治療と遺伝子治療におけるこれらの課題をゲノム編集iPS細胞を用いて解決することに取り組んでいます。
私たちが開発を進める難治性脳疾患に対する治療用細胞は、樹立したiPS細胞にゲノム編集によりCD-UPRT遺伝子を導入し、神経幹細胞(Neural Stem Cells, NSCs)に分化誘導した治療用NSCです。iPS細胞を用いることによる生産性の向上に加え、プロドラッグを細胞殺傷性ドラッグに変換する自殺遺伝子を導入することで、細胞の脳内投与における高い安全性を確保しています。
また神経幹細胞は、脳腫瘍や脳障害部位から分泌される各種ケモカインを感知し集積する性質があるため、導入した遺伝子の運び屋としての機能も期待できます。
私たちは、ゲノム編集技術とiPS細胞技術を融合した治療用NSCを、悪性脳腫瘍や脳機能障害に対する新たなソリューションとして開発を進めています。
私たちの強み
-
01
優れた治療効果
使用する治療用NSCは、脳関連疾患において高い治療効果を有します。さらに、腫瘍や免疫細胞から放出されるケモカインを検知し遊走する性質があり、脳腫瘍や脳障害部位に集積し、効率よく治療効果を示すことが期待できます。
-
02
高い生産性
優れた細胞治療薬候補として期待されている神経幹細胞ですが、ヒト由来細胞の入手が困難であること、安定的な製造が難しいことから、臨床応用はなかなか進んでおりません。私たちの治療用NSCは、臨床応用可能な分化誘導技術を用い、iPS細胞から作製しているため、品質の安定と商業ベースでの大量の製造が可能です。
-
03
高い安全性
高い生産性が特徴のiPS細胞ですが、臨床応用においては造腫瘍性リスクが課題です。その回避のため、本治療用NSCにはプロドラッグの投与により腫瘍障害性を有するドラッグを合成する遺伝子(自殺遺伝子)が組み込まれています。投与した治療用NSCに腫瘍化する恐れが生じた場合でも、プロドラッグを投与することで安全に体内から排除できます。いわば安全装置を組み込んだiPS細胞です。
対象疾患
私たちはこの治療用NSCを用い、以下の二つの難治性疾患を対象として治療法の開発を進めています。
